Wie Viele Valenzelektronen Hat Sauerstoff
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| [He] 2s2 2p4 8 O Periodensystem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Sauerstoff, O, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Nichtmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 16, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | Farbloses Gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7782-44-7 (Otwo) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-956-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.029.051 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | V03AN01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 49,iv %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 15,999 (15,99903 – 15,99977)[three] [4] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | lx (48) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 73 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | xiii . 618055(vii) eV[five] ≈ 1313 . 94 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ii. Ionisierungsenergie | 35 . 12112(half-dozen) eV[5] ≈ 3388 . 67 kJ/mol[half-dozen] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 54 . 93554(12) eV[5] ≈ 5300 . 47 kJ/mol[half-dozen] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iv. Ionisierungsenergie | 77 . 41350(25) eV[5] ≈ 7469 . 27 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 113 . 8990(5) eV[5] ≈ ten989 . half dozen kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| half dozen. Ionisierungsenergie | 138 . 1189(21) eV[5] ≈ thirteen326 . 4 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig (O2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | ane,429 kg · m−3 [7] bei 273,15 One thousand | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,9 · 10−6)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 54,8 K (−218,3 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 90,15 One thousand[nine] (−183 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | vi,82 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 0,222 kJ·mol−ane | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 317,5 chiliad·due south−1 bei 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 920 J·kg−1·K−1 bei 298 Grand | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,02658 W·chiliad−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −2, −i, 0, +1, +ii | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 1,23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | three,44 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sauerstoff (historisch auch Oxygenium, kurz Oxygen, genannt; gebildet aus altgriechisch ὀξύς oxýs „scharf, spitz, sauer" und -gen, zusammen „Säureerzeuger, Säurebildner") ist ein chemisches Element mit dem Elementsymbol O. Entsprechend seiner Ordnungszahl viii steht es an achter Stelle im Periodensystem und dort zusammen mit den Elementen Schwefel, Selen, Tellur, Polonium und Livermorium, die die Chalkogene bilden, in der sechsten Hauptgruppe, bzw. 16. IUPAC-Gruppe. Sauerstoff ist bezüglich der Masse mit 48,9 %[eleven] das häufigste Element der Erdkruste, das häufigste Element der Erdhülle und mit rund 30 % das zweithäufigste Element der Erde insgesamt (Eisen ist an i. Stelle).[12]
Unter Normalbedingung tritt Sauerstoff in Form eines kovalenten Homodimers auf, as well einer Verbindung aus zwei Sauerstoff-Atomen und mit der Summenformel Otwo , bezeichnet als molekularer Sauerstoff, Dioxygen oder Disauerstoff. Es ist ein farb- und geruchloses Gas, das in der Luft zu xx,942 % enthalten ist. Es ist an vielen Verbrennungs- und Korrosionsvorgängen beteiligt. Fast alle Lebewesen benötigen Sauerstoff zum Leben (in der Regel geben Pflanzen aber während der Photosynthese mehr Sauerstoff ab, als sie verbrauchen). Sie entnehmen ihn meistens durch Atmung aus der Luft oder durch Resorption aus Wasser (gelöster Sauerstoff). In hohen Konzentrationen dagegen ist er für dice meisten Lebewesen giftig.
Die metastabile, energiereiche und reaktive allotrope Form aus drei Sauerstoffatomen (O3) wird Ozon genannt.
Atomarer Sauerstoff, das heißt Sauerstoff in Form freier, einzelner Sauerstoffatome, kommt stabil nur unter extremen Bedingungen vor, beispielsweise im Vakuum des Weltalls oder in heißen Sternatmosphären. Er hat jedoch eine wesentliche Bedeutung als reaktives Zwischenprodukt in vielen Reaktionen der Atmosphärenchemie.
Geschichte

Carl Wilhelm Scheele, einer der Entdecker des Sauerstoffs
Im 18. Jahrhundert haben Carl Wilhelm Scheele (um 1772, veröffentlicht 1777) in Schweden und Joseph Priestley in England (1771, öffentlich beschrieben 1774) unabhängig voneinander im Zusammenhang mit der Erforschung von Verbrennungsvorgängen den Sauerstoff entdeckt.[thirteen] [14] Der Entdeckung sehr nahe kam auch Pierre Bayen (1774).
Mit der Entdeckung des Sauerstoffs wurde die von Georg Ernst Stahl eingeführte Hypothese vom Phlogiston, das bei Verbrennungsprozessen entweichen sollte, zu Fall gebracht.[fifteen] Von der Steinzeit bis über das Mittelalter hinaus war das Feuer für den Menschen eine Erscheinung, die als Gabe des Himmels hingenommen wurde. Über das Wesen des Feuers entstanden verschiedene Vorstellungen durch dice Naturphilosophen der Antike bis zu den Alchimisten. Das Feuer wurde auch als ein Grundstoff der Vier-Elemente-Lehre verstanden. Im 17. Jahrhundert entstand die Vorstellung eines „leichten geheimnisvollen Stoffs". Dieses „Phlogiston" würde aus dem brennenden Stoff entweichen, Wärme wurde als Stoff verstanden. Der deutsch-schwedische Apotheker Carl Wilhelm Scheele stellte Versuche an. Beim Erhitzen von Braunstein (Mangandioxid) oder Kaliumpermanganat mit konzentrierter Schwefelsäure (Vitriol) erhielt er ein farbloses Gas. Dieses Gas förderte die Verbrennung und Scheele nannte es „Feuerluft" oder nach der Herkunft „Vitriolluft". Er fand, dass Luft aus diesem Sauerstoff und „verdorbener Luft" besteht. Gänzlich unabhängig konnte der Engländer Joseph Priestley zwei Jahre später durch Erhitzen von Quecksilberoxid Sauerstoffgas herstellen. Der Brite veröffentlichte seine Erkenntnisse im Jahr 1774, Scheele publizierte sein Buch Chemische Abhandlung von der Luft und dem Feuer allerdings erst 1777.[16]
Mit der Entdeckung des Sauerstoffs state of war seine Bedeutung bei der Verbrennung noch nicht geklärt. Der Franzose Antoine de Lavoisier fand bei seinen Experimenten, dass bei der Verbrennung nicht Phlogiston entweicht, sondern Sauerstoff gebunden wird. Durch Wägung wies er nach, dass ein Stoff nach der Verbrennung nicht leichter, sondern schwerer war. Ursache war das zusätzliche Gewicht des während des Verbrennungsprozesses aufgenommenen Sauerstoffs. Anfangs wurde der Sauerstoff als Grundbestandteil für die Bildung von Säuren angenommen. Deshalb wurde 1779 von Lavoisier die Bezeichnung Oxygenium („Säurebildner") für Sauerstoff vorgeschlagen. Tatsächlich enthalten die meisten anorganischen Säuren bei der Lösung von Nichtmetalloxiden in Wasser Sauerstoff. Dice Halogene, wie Chlor und Brom, hielt man daher lange Zeit für Oxide unbekannter Elemente. Erst später wurde erkannt, dass Wasserstoff für den Säurecharakter verantwortlich ist (Humphry Davy, ab 1808). 1883 gelang es Karol Olszewski und Zygmunt Wróblewski erstmals, Flüssigsauerstoff herzustellen.
Vorkommen
Vorkommen auf der Erde


Sauerstoff ist das häufigste und am weitesten verbreitete Chemical element auf der Erde.[17] Es kommt sowohl in der Erdatmosphäre als auch in der Lithosphäre, der Hydrosphäre und der Biosphäre vor. Sauerstoff hat einen Massenanteil von l,v %[xviii] an der Erdhülle (bis xvi km Tiefe, einschließlich Hydro- und Atmosphäre). An der Luft beträgt sein Massenanteil 23,16 %[19] (Volumenanteil: 20,95 %[nineteen]), im Wasser 88,8 %[19] (im Meerwasser allerdings nur 86 %,[nineteen] da dort größere Mengen nichtsauerstoffhaltiger Salze, z. B. Natriumchlorid, gelöst sind).
Zumeist kommt Sauerstoff in seinen Verbindungen auf und in der Erde vor. In der Erdhülle sind neben Wasser fast alle Minerale und damit Gesteine sauerstoffhaltig. Zu den wichtigsten Sauerstoff enthaltenden Mineralen zählen Silicate wie Feldspate, Glimmer und Olivine, Carbonate wie das Calciumcarbonat im Kalkstein sowie Oxide wie Siliciumdioxid als Quarz.
Im elementarem Zustand befindet sich Sauerstoff in Form von O2 gasförmig in der Atmosphäre und gelöst in Gewässern. Die Menge des relativ reaktionsfreudigen elementaren Sauerstoffs bleibt auf Dauer nur konstant, weil Sauerstoff produzierende Pflanzen and so viel nachliefern, wie von aerob atmenden Lebewesen sowie durch andere Verbrennungsprozesse wieder verbraucht wird. Ohne diesen biologischen Kreislauf würde Sauerstoff nur in Verbindungen vorkommen, elementarer Sauerstoff existiert also in einem Fließgleichgewicht. Die Entwicklung der Sauerstoffkonzentration in der Erdatmosphäre ist im Artikel Entwicklung der Erdatmosphäre beschrieben. Das Sauerstoff-Allotrop O3 Ozon ist in der Atmosphäre nur in geringer Konzentration vorhanden.
Vorkommen im Weltall
Im Weltall ist Sauerstoff nach Wasserstoff und Helium das dritthäufigste Chemical element. Der Massenanteil von Sauerstoff beträgt im Sonnensystem etwa 0,8 % (dies entspricht einem (Atom-)Anzahlanteil von etwa 500 ppm).[20] [21]
Sauerstoff ist nicht in der primordialen Nukleosynthese entstanden, entsteht aber in verhältnismäßig großen Mengen in Riesensternen durch Heliumbrennen. Dabei wird zunächst aus drei Heliumkernen 12C gebildet (Drei-Alpha-Prozess), das anschließend mit einem weiteren Heliumkern zu 16O fusioniert. 18O wird durch Fusion eines ivHe- mit einem 14N-Kern gebildet. Auch in so genannten Hauptreihensternen wie der Sonne spielt Sauerstoff bei der Energiegewinnung eine Rolle. Beim CNO-Zyklus (Bethe-Weizsäcker-Zyklus) stellt Sauerstoff ein Zwischenprodukt der Kernreaktion dar, bei der durch Protoneneinfang eines 12C-Kerns, der als Katalysator wirkt, ein 4He-Kern (Alpha-Teilchen) entsteht. In extrem schweren Sternen kommt es in der Spätphase ihrer Entwicklung zum Sauerstoffbrennen, bei dem der Sauerstoff als nuklearer Brennstoff für Reaktionen dient, die zum Aufbau noch schwererer Kerne führen.
Dice meisten Weißen Zwerge, die nach Stand der Theorie den Endzustand von 97 % aller Sterne darstellen, bestehen neben Helium und Kohlenstoff zu einem großen Teil aus Sauerstoff.[22]
Gewinnung und Darstellung

Verfahren zur industriellen Sauerstoff-Gewinnung nach Linde.
Technisch wird Sauerstoff heute fast ausschließlich durch Rektifikation von Luft gewonnen. Das Verfahren wurde 1902[18] zunächst von Carl von Linde entwickelt (Linde-Verfahren) und von Georges Claude wirtschaftlich rentabel gestaltet. Technisch unbedeutende Mengen ergeben sich als Nebenprodukt bei der Wasserstoffproduktion durch Elektrolyse von Wasser.
Zur Sauerstoffgewinnung nach dem Claude-Verfahren wird Luft mit Hilfe von Verdichtern auf five–6 bar verdichtet, abgekühlt und dann zunächst durch Filter von Kohlenstoffdioxid, Luftfeuchtigkeit und anderen Gasen befreit. Die verdichtete Luft wird durch vorbeiströmende Gase aus dem Prozess auf eine Temperatur nahe dem Siedepunkt abgekühlt. Danach wird sie in Turbinen expandiert. Dabei kann ein Teil der zur Kompression eingesetzten Energie wieder zurückgewonnen werden.[23] Dadurch wird das Verfahren – im Gegensatz zum Linde-Verfahren, bei dem keine Energie zurückgewonnen wird – deutlich wirtschaftlicher.
Dice eigentliche Trennung von Stickstoff und Sauerstoff erfolgt durch Destillation in zwei Rektifikationskolonnen mit unterschiedlichen Drücken. Die Destillation erfolgt dabei im Gegenstromprinzip, das heißt durch die Kondensationswärme verdampftes Gas strömt nach oben, kondensierte Flüssigkeit tropft nach unten. Da Sauerstoff einen höheren Siedepunkt als Stickstoff besitzt, kondensiert er leichter und sammelt sich and then am Boden, Stickstoff am Kopf der Kolonne. Dice Trennung erfolgt zunächst bei v–6 bar[24] in der sogenannten Mitteldruckkolonne.[23] Die dabei entstehende sauerstoffangereicherte Flüssigkeit wird anschließend in der Niederdruckkolonne (Druck etwa 0,5 bar[24]) weiter getrennt. Durch den flüssigen Sauerstoff der Niederdruckkolonne wird gasförmiger Stickstoff der Hochdruckkolonne geleitet. Dabei verflüssigt sich dieser und erwärmt mit der abgegebenen Kondensationswärme die Flüssigkeit. Der leichter flüchtige Stickstoff wird bevorzugt abgegeben und es bleibt gereinigter flüssiger Sauerstoff zurück. Dieser enthält noch dice Edelgase Krypton und Xenon, die in einer separaten Kolonne abgetrennt werden.
Um mittlere oder kleine Mengen Sauerstoff zu produzieren, kann Sauerstoff aus der Luft durch Druckwechsel-Adsorption von anderen Gasen getrennt werden. Dazu strömt Luft durch Molekularsiebe, wobei Stickstoff und Kohlenstoffdioxid adsorbiert werden und nur Sauerstoff und Argon hindurch gelangen.[25] Dies wird im überwiegend medizinisch verwendeten Sauerstoffkonzentrator genutzt.
Ein älteres Verfahren ist das auf chemischen Reaktionen beruhende Bariumoxid-Verfahren. Es ist infolge des hohen Energieaufwandes unwirtschaftlich. Dafür wird Bariumoxid unter Luftzufuhr auf 500 °C erhitzt, wobei sich Bariumperoxid bildet. Beim Erhitzen auf 700 °C wird der zuvor aufgenommene Sauerstoff durch Thermolyse wieder freigesetzt. Vor Entwicklung des Linde-Verfahrens war dieses Verfahren dice einzige Möglichkeit, reinen Sauerstoff darzustellen.
-
- Bildung des Bariumperoxids
-
- Freisetzung von Sauerstoff und Rückgewinnung des Bariumoxids
Einige sauerstoffreiche anorganische Verbindungen wie Kaliumpermanganat, Kaliumnitrat (Salpeter), Kaliumchlorat und Kaliumchromat geben bei Erwärmung oder Reaktion mit Reduktionsmitteln Sauerstoff ab.
Eine weitere Möglichkeit, Sauerstoff im Labor zu erzeugen, ist dice Zersetzung von Wasserstoffperoxid an platinierter Nickelfolie.[24]
Reinen Sauerstoff kann man mittels Elektrolyse von 30%iger Kalilauge an Nickelelektroden erhalten. Dabei entstehen Wasserstoff und Sauerstoff getrennt voneinander.
- Kathodenreaktion
- Anodenreaktion
Eigenschaften
Physikalische Eigenschaften
Molekularer Sauerstoff ist ein farb-, geruch- und geschmackloses Gas, welches bei 90,xv Grand (−183 °C) zu einer bläulichen Flüssigkeit kondensiert. In dicken Schichten zeigt gasförmiger und flüssiger Sauerstoff eine blaue Farbe. Unterhalb von 54,iv K (−218,75 °C) erstarrt Sauerstoff zu blauen Kristallen. Im Feststoff liegen paramagnetische O2-Moleküle mit einem O–O-Abstand von 121 pm (Doppelbindung) vor. Das Element kommt fest in mehreren Modifikationen vor. Zwischen 54,4 K und 43,8 G[19] liegt Sauerstoff in der kubischen γ-Modifikation und zwischen 43,8 M und 23,ix 1000[19] in einer rhomboedrischen β-Modifikation vor. Unterhalb von 23,9 Grand ist schließlich dice monokline α-Modifikation am stabilsten. Es ist – im Gegensatz zu anderen Nichtmetallen – paramagnetisch und besitzt diradikalischen Charakter. Der Tripelpunkt liegt bei 54,36 K (−218,79 °C) und 0,1480 kPa.[26] Der kritische Punkt liegt bei einem Druck von 50,4 bar und einer Temperatur von 154,seven K (−118,4 °C).[27] Dice kritische Dichte beträgt 0,436 g/cm3.[28] Dice Dichte als Flüssigkeit bei Normaldruck beträgt 1,142 g/cmthree.[29]
Sauerstoff ist in Wasser wenig löslich. Die Löslichkeit ist abhängig vom Druck und der Temperatur. Sie steigt mit abnehmender Temperatur und zunehmendem Druck. Bei 0 °C lösen sich aus Luft unter Normaldruck (Sauerstoffpartialdruck von 212 hPa) im Gleichgewicht 14,16 mg/l Sauerstoff.

In der Sauerstoff-Gasentladungs-Spektralröhre werden die Molekülorbitale des Sauerstoffs zum Leuchten angeregt. Die Betriebsbedingungen sind dabei ein Druck von ca. 5–ten mBar, eine Hochspannung von 1,8 kV, eine Stromstärke von 18 mA und eine Frequenz von 35 kHz. Bei der Rekombination der ionisierten Gasmoleküle wird das charakteristische Farbspektrum abgestrahlt.[30] Hierbei wird zum kleinen Teil, bedingt durch die Zuführung von Energie, reversibel Ozon gebildet.
Molekülorbitale
Die Bindung und die Eigenschaften des Sauerstoff-Moleküls können sehr gut mit dem Molekülorbital-Modell erklärt werden. Dabei werden dice due south- und p-Atomorbitale der einzelnen Atome zu bindenden und antibindenden Molekülorbitalen zusammengesetzt. Die 1s- und 2s-Orbitale der Sauerstoffatome werden jeweils zu σs und σs*- bindenden und antibindenden Molekülorbitalen. Da diese Orbitale vollständig mit Elektronen gefüllt sind, tragen sie nicht zur Bindung bei. Aus den 2p-Orbitalen werden insgesamt sechs Molekülorbitale mit unterschiedlichem Energieniveau. Dies sind dice bindenden σp-, π10- und πy- sowie dice entsprechenden antibindenden σp*-, πx*- und πy*-Molekülorbitale.
Die π-Orbitale besitzen dabei gleiche Energie. Werden Elektronen in die Molekülorbitale verteilt, kommt es zur folgenden Aufteilung der acht p-Elektronen: sechs füllen dice bindenden und zwei in dice antibindenden π*-Orbitale; dice Bindungsordnung beträgt also (6–ii)/2 = ii. Diese beiden bestimmen als Valenzelektronen die Eigenschaften des O2-Moleküls. Sauerstoff besitzt für die Verteilung dieser Elektronen insgesamt drei erlaubte und energetisch erreichbare quantenmechanische Zustände.

Besetzung der Energieniveaus der Molekülorbitale des Sauerstoffs in Grund- und angeregten Zuständen
Im Grundzustand sind die Spins der beiden Valenzelektronen der Hundschen Regel gehorchend parallel angeordnet. Es handelt sich also um einen Triplett-Zustand mit dem Termsymbol 3Σ1000. Er ist der Zustand mit der niedrigsten Energie. Durch die beiden ungepaarten Elektronen sind die zwei π*-Orbitale nur halb besetzt. Diese verursacht einige charakteristische Eigenschaften, wie den diradikalischen Charakter und den Paramagnetismus des Sauerstoff-Moleküls.
Trotz der formalen Bindungsordnung „zwei" lässt sich keine entsprechende korrekte Valenzstrichformel für O2 angeben. <O=O> bringt den Doppelbindungscharakter zum Ausdruck, ignoriert aber sowohl die besetzten antibindenden Orbitale als auch den Radikalcharakter. Die Schreibweise ·O̲̅-O̲̅· wird verwendet, um die biradikalischen Eigenschaften hervorzuheben, deutet jedoch nur eine Bindungsordnung von eins an. Um dice Bindungsordnung zwei und den radikalischen Charakter anzudeuten, sollte die Darstellung <O÷O> mit Radikalpunkten auf dem Bindungsstrich verwendet werden.
Singulett-Sauerstoff
Sauerstoff besitzt zwei unterschiedliche angeregte Zustände, die beide eine deutlich größere Energie als der Grundzustand besitzen. Bei beiden Zuständen sind die Spins der Elektronen entgegen der Hundschen Regel antiparallel ausgerichtet. Der stabilere angeregte Sauerstoff wird nach der quantenmechanischen Bezeichnung für diesen Zustand auch Singulett-Sauerstoff (1O2) genannt. Dice beiden Singulett-Zustände unterscheiden sich dadurch, ob sich die beiden Elektronen in einem (Termsymbol: 1Δg) oder beiden π*-Orbitalen (Termsymbol: oneΣg) befinden. Der 1Σg-Zustand ist energetisch ungünstiger und wandelt sich sehr schnell in den 1Δm-Zustand um. Der iΣk-Zustand ist diamagnetisch, der energetisch stabilere 1Δthousand-Zustand zeigt jedoch aufgrund des vorhandenen Bahnmomentes (die der Projektion des Bahndrehimpulses auf die Kern-Kern-Verbindungsachse entsprechende Quantenzahl – symbolisiert durch Σ, Π, Δ etc. – hat im iΔone thousand-Zustand den Wert ±2) Paramagnetismus vergleichbarer Stärke wie der von Triplett-Sauerstoff.[31] [32]
Die Bildung von Singulett-Sauerstoff ist auf verschiedenen Wegen möglich: sowohl photochemisch aus Triplett-Sauerstoff, als auch chemisch aus anderen Sauerstoffverbindungen. Eine direkte Gewinnung aus Triplett-Sauerstoff durch Bestrahlung mit elektromagnetischer Strahlung (z. B. Licht) ist allerdings aus quantenmechanischen Gründen, in Form der Auswahlregeln für die Emission oder Absorption von elektromagnetischer Strahlung, ausgeschlossen. Eine Möglichkeit, dieses Verbot zu umgehen, ist dice gleichzeitige Bestrahlung mit Photonen und Kollision zweier Moleküle. Durch diesen unwahrscheinlichen Vorgang, der in der flüssigen Phase wahrscheinlicher ist, entsteht die blaue Farbe des flüssigen Sauerstoffs (Assimilation im roten Spektralbereich). Auch mit Hilfe geeigneter Farbstoffe, wie Methylenblau oder Eosin, lässt sich auf photochemischem Weg Singulett-Sauerstoff darstellen.[33] Chemisch wird er aus Peroxiden gewonnen. Bei der Umsetzung von Wasserstoffperoxid mit Natriumhypochlorit entsteht zunächst dice instabile Peroxohypochlorige Säure, die schnell in Chlorwasserstoff bzw. Chlorid und Singulett-Sauerstoff zerfällt. Experimentell kann human being auch Chlor in eine alkalische Wasserstoffperoxidlösung einleiten, wobei dann zunächst Hypochlorit entsteht, das dann weiter reagiert. Der Singulett-Sauerstoff reagiert schnell mit Emissionen im roten Bereich bei 633,four nm und 703,2 nm zu Triplett-Sauerstoff.[34] [35]
Diese Grade von Sauerstoff ist ein starkes und selektives Oxidationsmittel und wird in der organischen Chemie häufig verwendet.[36] [37] [38] [39] And then reagiert er im Gegensatz zu normalen Sauerstoff mit 1,3-Dienen in einer [4+two]-Cycloaddition zu Peroxiden. Mit Alkenen und Alkinen reagiert Singulett-Sauerstoff in einer [2+2]-Cycloaddition.
Chemische Eigenschaften
Sauerstoff reagiert mit den meisten anderen Elementen direkt und bildet Oxide. Es gibt einige Ausnahmen, insbesondere unter den Nichtmetallen und Edelmetallen. Mit einigen Elementen, zum Beispiel Kohlenstoff und Schwefel, reagiert Sauerstoff nur bei hohen Temperaturen. Bei der Verbrennung wird sehr viel Energie frei und es entstehen Flammen.[40] [41]
- Verbrennung von Kohlenstoff zu Kohlenstoffdioxid
- Verbrennung von Schwefel zu Schwefeldioxid
Mit Stickstoff sind Reaktionen nur unter speziellen Bedingungen, etwa bei Blitzen, aber auch im Verbrennungsmotor[42] möglich. Dabei entstehen Stickoxide. Fluor bildet nur bei tiefen Temperaturen unter elektrischen Entladungen die instabile Verbindung Disauerstoffdifluorid (O2F2).[43]
- Reduktion von Fluor zu Disauerstoffdifluorid
Das edelste Metall Aureate, dice Halogene Chlor, Brom und Iod, sowie die Edelgase reagieren nicht direkt mit Sauerstoff. Einige weitere Edelmetalle wie Platin und Silber reagieren nur schlecht mit Sauerstoff.
Elementarer, gasförmiger Sauerstoff ist relativ reaktionsträge, viele Reaktionen finden bei Normalbedingungen gar nicht oder nur langsam statt. Der Grund hierfür liegt darin, dass die Reaktionen mit anderen Stoffen kinetisch gehemmt sind. Zur Reaktion werden entweder eine hohe Aktivierungsenergie oder sehr reaktive Radikale benötigt. Diese Barriere kann durch Temperaturerhöhung, Licht oder Katalysatoren, beispielsweise Platin, überschritten werden. Zusätzlich wird bei vielen Metallen die Reaktion dadurch gehindert, dass das Cloth mit einer dünnen Metalloxidschicht überzogen ist und dadurch passiviert wird. Bei einigen Reaktionen wie der Knallgasreaktion reichen wenige Radikale für eine Reaktion aus, da diese nach einem Kettenreaktions-Mechanismus weiterreagieren.
- Verbrennung von Wasserstoff zu Wasser
Deutlich stärker oxidierend als gasförmiger Sauerstoff wirkt trotz der tiefen Temperaturen flüssiger Sauerstoff. In diesem bildet sich der reaktive Singulett-Sauerstoff leicht. Auch in Gegenwart von Wasser oder Wasserdampf verlaufen viele Oxidationen mit Sauerstoff leichter.
Reaktionen mit Sauerstoff sind fast immer Redox-Reaktionen, bei denen Sauerstoff in der Regel zwei Elektronen aufnimmt und and then zum Oxid reduziert wird. Das Element zählt somit zu den Oxidationsmitteln. Häufig verlaufen diese Reaktionen bedingt durch die große freiwerdende Bindungs- oder Gitterenergie unter starker Wärmeabgabe. Es gibt auch explosionsartig verlaufende Reaktionen, wie die Knallgasreaktion oder Staubexplosionen von feinverteilten Stoffen in Luft oder reinem Sauerstoff.
Allotrope
Neben dem in diesem Artikel beschriebenen Disauerstoff Otwo bildet Sauerstoff mehrere Allotrope, die nach der Anzahl Sauerstoffatome zu unterscheiden sind. Das wichtigste Allotrop ist dabei Ozon O3, daneben sind die selteneren Allotrope Tetrasauerstoff (Oiv) und Oktasauerstoff (O8) bekannt.
Ozon
Ozon (O3) ist ein blaues, charakteristisch riechendes Gas, das aus drei Sauerstoff-Atomen besteht. Es ist instabil, sehr reaktiv und ein starkes Oxidationsmittel. Gebildet wird es aus molekularem Sauerstoff und Sauerstoff-Atomen, aber auch z. B. durch Reaktion von Stickstoffdioxid mit Sauerstoff unter UV-Strahlung.
Aufgrund seiner hohen Reaktivität ist es in Bodennähe der menschlichen Gesundheit eher abträglich – in der Ozonschicht der Erdatmosphäre dagegen spielt das Ozon eine wichtige Rolle bei der Absorption der auf die Erde treffenden UV-Strahlung.
Andere Allotrope
Eine Hochdruckphase des Sauerstoffs entsteht bei Drücken größer x GPa als roter Feststoff. Nach kristallographischen Untersuchungen wird angenommen, dass es sich um Oktasauerstoff Oeight-Ringe handelt. Daneben existiert Tetrasauerstoff als ein sehr seltenes und instabiles Allotrop des Sauerstoffs. Es konnte 2001 im Massenspektrometer nachgewiesen werden.[44] [45] In geringer Konzentration kommt es in flüssigem Sauerstoff vor.
Isotope
Das häufigste stabile Sauerstoffisotop ist sixteenO (99,76 %), daneben kommt noch xviiiO (0,twenty %) sowie 17O (0,037 %) vor. Neben den stabilen Sauerstoffisotopen sind noch insgesamt 13 instabile, radioaktive Nuklide von 12O bis 28O[46] bekannt, die nur künstlich herstellbar sind. Ihre Halbwertszeiten betragen meist nur Millisekunden bis Sekunden, 15O besitzt dabei mit zwei Minuten die längste Halbwertszeit[46] und wird häufig in der Positronen-Emissions-Tomographie verwendet.
Als einziges stabiles Isotop besitzt das seltene 17O einen Kernspin von 5/2 [47] und kann damit für NMR-Untersuchungen verwendet werden. Die anderen stabilen Isotope besitzen den Kernspin 0 und sind damit NMR-inaktiv.
Indirekte Temperaturmessung über das δ18O-Bespeak
Wassermoleküle mit dem um 12 % leichteren xviO verdunsten schneller. Deshalb müssen Eisschichten mit einem höheren relativen Anteil an 18O aus wärmeren Zeiten stammen, da nur bei der starken Verdunstung wärmerer Perioden vermehrt xviiiO-Wasser mit zur Wolkenbildung beiträgt. Je höher dice globale Temperatur ist, desto weiter können mit schweren Sauerstoffisotopen beladene Wolken in die Polarregionen vordringen, ohne vorher abzuregnen.
In kälteren Perioden befindet sich mehr 18O in Meeressedimenten. Meereis besteht hauptsächlich aus den leichteren Wassermolekülen aus xviO. Wenn es in einer Kaltphase zu einer starken Neubildung von Meereis kommt, bleibt vermehrt Meerwasser aus 18O zurück, welches durch die permanente Einlagerung von Sauerstoff in dice Kalkschalen der Meerestiere (Calciumcarbonat) verstärkt in Sedimentschichten dieser Zeit nachweisbar ist. Auch gibt es regionale Unterschiede in der xviiiO-Anreicherung in Organismen nach Fine art ihrer Trinkwasserquelle.
Durch eine Isotopenuntersuchung von Eisbohrkernen oder Sedimentproben und die Bestimmung des 18O-/16O-Verhältnisses mit Hilfe eines Massenspektrometers lassen sich Informationen über die Durchschnittstemperatur und damit die Klimaerwärmung und -abkühlung in früheren Zeiten gewinnen. Daneben kann durch Bestimmung der Zahl der Oszillationen zwischen warm (Sommer) und kalt (Winter) das Alter des Bohrkerns exakt bestimmt werden.
Verwendung
Sauerstoff wird für industrielle Verbrennungs-, Oxidations- und Heizprozesse, in der Medizin und in Luft- und Raumfahrt verwendet.
Medizin
Sauerstoff zur Anwendung in der Humanmedizin unterliegt aufgrund gesetzlicher Regelungen einer strengen Kontrolle. Der in weiß gekennzeichneten Flaschen abgefüllte medizinische Sauerstoff aureate in Deutschland als Fertigarzneimittel im Sinne des Arzneimittelgesetzes (AMG).[48]
Vorsicht ist bei der Sauerstoffgabe geboten, wenn Patienten an einer chronischen Lungenerkrankung (siehe COPD) mit erhöhtem CO2-Partialdruck leiden. Bei ihnen kann das plötzliche „Überangebot" an Sauerstoff zu einer COii-Narkose mit Atemstillstand führen.[49]
Notfallmedizin
Verletzungen und viele Erkrankungen der Lunge sowie einige Herzkrankheiten und insbesondere Schockzustände können zu einem Sauerstoffmangel (Hypoxie) in den Schlagadern (Arterien) und im Gewebe lebenswichtiger Organe führen. Aus diesem Grund wird Patienten in der Notfall- und Intensivmedizin sehr häufig zusätzlicher Sauerstoff verabreicht. Bei selbstständig atmenden Patienten wird die Umgebungsluft mit Hilfe verschiedener Sonden und Masken mit Sauerstoff angereichert, bei künstlich beatmeten Patienten wird der Sauerstoff im Beatmungsgerät zugemischt. Der Effekt der Sauerstoffanreicherung im Blut ist mit Hilfe der Pulsoxymetrie oder anhand von Blutgasanalysen messbar.[fifty]
Sauerstoff-Langzeittherapie
Bei Krankheiten mit einem schweren chronischen Sauerstoffmangel im Blut werden durch eine langfristige und täglich mehrstündige Zufuhr von Sauerstoff (Sauerstoff-Langzeittherapie) sowohl dice Lebensqualität als auch die Überlebensdauer verbessert.[51] Der reine Sauerstoff kann bei der Beatmung zu Problemen wegen Verdrängens des Kohlenstoffdioxid aus den Gefäßen[52] sowie zur unerwünschten Erhöhung der Hirnaktivität in Hypothalamus, der Insula sowie im Hippocampus führen. Diese negativen Folgen werden durch den Zusatz von Kohlenstoffdioxid vermieden.[53]
Cluster-Kopfschmerz
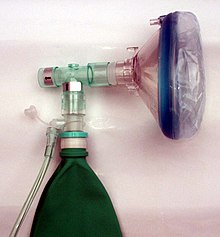
Nach den Empfehlungen der Weltgesundheitsorganisation ist das Einatmen von Sauerstoff zur Behandlung von Cluster-Kopfschmerz-Attacken geeignet.[54] Die Anwendung von hochkonzentriertem Sauerstoff mittels spezieller Maskensysteme lindert die Beschwerden in der Regel innerhalb von Minuten effektiv.[55]
Technik
Industriell verwendet wird Sauerstoff hauptsächlich in der Metallurgie zur Herstellung von Roheisen und Stahl, sowie bei der Kupfer-Raffination. Reiner Sauerstoff oder sauerstoffangereicherte Luft dient hier einerseits zum Erreichen hoher Temperaturen, andererseits zum Frischen des Rohstahls, d. h. zum Entfernen unerwünschter Beimengungen von Kohlenstoff, Silicium, Mangan und Phosphor, die oxidiert und abgetrennt werden. Reiner Sauerstoff hat im Vergleich zu Luft den Vorteil, dass kein Stickstoff in dice Schmelze eingetragen wird. Stickstoff hat einen negativen Einfluss auf die mechanischen Eigenschaften von Stahl (siehe auch Thomas-Verfahren). In chemischen Prozessen wird Sauerstoff meist zur Oxidation von verschiedenen Grundstoffen, wie bei der Olefin-Oxidation von Ethen zu Ethylenoxid und bei der teilweisen (partiellen) Oxidation von Schweröl und Kohle verwendet. Benötigt wird Sauerstoff außerdem zur Erzeugung von Wasserstoff- und Synthesegas und der Herstellung von Schwefel- und Salpetersäure. Weitere durch Oxidation mit Sauerstoff hergestellte wichtige Produkte sind Acetylen (Ethin), Acetaldehyd, Essigsäure, Vinylacetat und Chlor.
Verschiedene Brenngase (Propan, Wasserstoff, Ethin u. a.) erzielen erst durch Mischen mit Sauerstoff ausreichend heiße und rußfreie Flammen zum Schweißen und Hartlöten oder Erschmelzen und Formbarmachen von Glas. Nach Aufheizen und Zünden erfolgt das Schneiden von Beton mit einer (selbst abbrennenden) Sauerstofflanze oder das Brennschneiden von Eisen alleine durch einen scharfen Sauerstoffstrahl.
Sauerstoff wird ebenso verwendet zur Darstellung von Ozon, als Oxidationsmittel in Brennstoffzellen und in der Halbleitertechnik. In der Raketentechnik wird flüssiger Sauerstoff als Oxidationsmittel verwendet und mit LOX (liquid oxygen) abgekürzt.
In der Umwelttechnik werden Abwässer durch Einleitung von Sauerstoffgas schneller durch Bakterien von organischen Schadstoffen und Giften befreit. In vielen Trinkwasserwerken dient die Trinkwasseraufbereitung mit Ozon (Ozonierung) zur Oxidation von organischen Stoffen oder etwa Eisen und der Entkeimung und kann zu einer deutlich besseren Reinigungswirkung der Filteranlagen führen.[56]
Für dice Lebensmitteltechnik ist Sauerstoff als Lebensmittelzusatzstoff als E 948 zugelassen und wird – neben Stickstoff, Kohlendioxid und Lachgas als Treibgas, Packgas, Gas zum Aufschlagen von Sahne (Schlagobers) u. ä. verwendet.[57]
Wellness
In der Wellness- und Lebensmittelindustrie wird gelegentlich für Produkte geworben, die mit Sauerstoff angereichert seien. Then wird etwa abgepacktes Wasser verkauft, das einen erhöhten Sauerstoffgehalt haben soll. Eine positive Wirkung auf Gesundheit und Wohlbefinden ist nicht zu erwarten, denn Sauerstoff löst sich nur in geringer Menge in Wasser und wird in vielen Größenordnungen mehr – nämlich mit jedem Atemzug – über die Lunge als via Magen aufgenommen.[58]
Batterietechnik
Die Zink-Luft-Zelle ist ein Primärelement, das Luft aus der umgebenden Atmosphäre aufnimmt und den Sauerstoff chemisch mit dem Metall Zink umsetzt, um elektrische Spannung und Strom zu erzeugen. Der Vorzug dieses Batterietyps ist, dass er seine relativ hohe Energiedichte (bei geringer Stromentnahme) über einen ausgedehnten Zeitraum erstreckt abgeben kann. Das Verschlossenhalten der Ventilationsöffnung etwa durch einen Klebstreifen (Siegel) vor Gebrauch hilft die Alterung der Zelle bei Lagerung zu reduzieren. Gut faustgroße quaderförmige Zellen dieses Typs im Kunststoffgehäuse wurden um 1980 in Blinkleuchten zur Baustellenabsicherung eingesetzt und sind bis heute als Knopfzellen für Hinter-dem-Ohr-Hörgeräte üblich.
Forschung und Entwicklung gehen auch in Richtung Metall-Sauerstoff-Akkus auf Basis von Alkalimetallen. Ziel ist es, dice Energiedichte (Wattstunden pro Masse) von Lithium-Ionen-Akkus zu übertreffen.[59] [60]
Biologische Bedeutung


Sauerstoff befindet sich in der Natur in einem steten Kreislauf. Er wird ständig von autotrophen Lebewesen wie Cyanobakterien („Blaualgen"), Algen und Pflanzen bei der oxygenen Photosynthese durch Photolyse aus Wasser freigesetzt. Er ist ein Endprodukt dieser biochemischen Reaktion und wird an die Umwelt abgegeben. Cyanobakterien waren wahrscheinlich die ersten Organismen, die molekularen Sauerstoff als Abfallprodukt in der Atmosphäre anreicherten. Zuvor existierte eine praktisch sauerstofffreie, anaerobe Atmosphäre auf der Erde.
- vereinfachte Netto-Reaktionsgleichung für dice oxygene Photosynthese [61]
Die meisten aeroben Organismen, darunter dice meisten Eukaryoten, einschließlich des Menschen und der Pflanzen, und viele Bakterien, benötigen diesen Sauerstoff zum Leben. Eukaryoten brauchen ihn zur Energiegewinnung durch Oxidation in den Mitochondrien. Der Sauerstoff wird dabei in der Atmungskette wieder zu Wasser reduziert. Die Oxygenierung von Stoffwechselprodukten mithilfe von Enzymen (Oxygenasen) wird oft beim Abbau von Stoffen angewendet. Die Reaktion benötigt Sauerstoff und findet in allen aeroben Lebewesen statt.
- vereinfachte Netto-Reaktionsgleichung für dice aerobe Atmung [62]
Da Sauerstoff und einige seiner Verbindungen sehr reaktiv sind und Zellstrukturen zerstören können, besitzen Organismen Schutzenzyme wie Katalase und Peroxidase. Für Organismen, denen diese Enzyme fehlen, aber auch für Menschen bei zu hoher Konzentration[63] wirkt Sauerstoff toxisch. Beim Abbau des Sauerstoffs entstehen reaktive Sauerstoffspezies, wie freie Radikale, die ebenfalls biologische Moleküle zerstören können. Werden sie nicht schnell genug abgefangen, entsteht sogenannter oxidativer Stress, der für Alterungsprozesse verantwortlich gemacht wird.
In den Phagozyten (Fresszellen) des Immunsystems dienen diese reaktiven Sauerstoffspezies (Wasserstoffperoxid und Hyperoxidionen) neben Enzymen dazu, aufgenommene Krankheitserreger zu zerstören.
Problematische Auswirkungen
Wird reiner Sauerstoff oder Luft mit einem höheren Sauerstoffanteil über längere Zeit eingeatmet, kann es zur Vergiftung der Lunge, dem sogenannten Lorrain-Smith-Effekt kommen. Dabei werden dice Lungenbläschen (Lungenalveolen) durch Anschwellen in ihrer normalen Funktion gehindert.
Der Paul-Bert-Effekt bezeichnet eine Sauerstoffvergiftung des Zentralnervensystems. Diese kann bei Hochdruckatmung jeglicher Sauerstoff-Stickstoff-Gemische auftreten, das Risiko erhöht sich jedoch mit Erhöhung des Sauerstoffanteils und des Gesamtdrucks. Bei Sauerstoff-Teildrücken oberhalb 1,6 bar kommt es innerhalb relativ kurzer Zeit zu einer Vergiftung. Dies spielt beispielsweise beim Tauchen eine Rolle, da es die maximale Tauchtiefe abhängig vom Sauerstoffpartialdruck begrenzt.
In der Raumfahrt wird beispielsweise in Raumanzügen reiner Sauerstoff geatmet, allerdings unter stark vermindertem Druck, um gesundheitliche Folgen zu minimieren und weil der Raumanzug unter normalem Druck zu steif würde.
Hyperoxidanionen im Stoffwechsel
Hyperoxidanionen (alte Bezeichnung: Superoxidanionen) sind einfach negativ geladene und radikalische Sauerstoffionen (O2 −), die durch Elektronenübertragung auf molekularen Sauerstoff entstehen. Diese sind äußerst reaktiv. Mitunter werden sie als Nebenprodukt des Stoffwechsels (Metabolismus) wie durch Nebenreaktionen bei einigen Oxidasen (Xanthin-Oxidase) gebildet. Hyperoxidanionen entstehen ebenfalls beim Photosynthese-Komplex I und als Nebenprodukt der Atmungskette (mitochondriale Atmung). Xenobiotika und cytostatische Antibiotika fördern dabei ihre Entstehung. Beim Auftreten einer Entzündung wird durch eine membranständige NADPH-abhängige Oxidase Hyperoxidanionen ins extrazelluläre Milieu abgegeben. Sie führen zu oxidativem Stress. Beispielsweise kommt es beim Fettsäureabbau in den Peroxisomen zur Übertragung von Elektronen von FADHii auf molekularen Sauerstoff. Die entstandenen Hyperoxidanionen können zum Zellgift Wasserstoffperoxid weiterreagieren. Beim Ablauf der Atmungskette entstehen diese radikalischen Sauerstoffspezies in geringen Mengen. Es bestehen Vermutungen, dass die Erbgutschädigungen, die solche Sauerstoffspezies hervorrufen, an Alterungsprozessen beteiligt sind. Es ist daher für den Organismus von essentieller Bedeutung, diese Hyperoxidanionen zügig abzubauen. Dies geschieht mittels der Superoxid-Dismutase.
Analytik
Klassische Analytik
Gelöster Sauerstoff oxidiert zweiwertiges Mangan zu höheren Oxidationsstufen. Dieses wird nach der Methode von Winkler durch Iodid wieder vollständig reduziert. Die Stoffmenge des dabei gebildeten Iods steht in einem stöchiometrischen Verhältnis von i:2 zu der Stoffmenge des ursprünglich gelösten Sauerstoffs und kann iodometrisch mit Thiosulfat rücktitriert werden.[64]
Als einfacher Nachweis für das Vorhandensein von Sauerstoff wird dice Glimmspanprobe angewandt.
Instrumentelle quantitative Analytik
Die zur Verbrennungssteuerung von Otto-Motoren verwendete Lambdasonde misst den Sauerstoffgehalt im Autoabgas in Bezug zum Oii-Gehalt in der Umgebungsluft. Dazu wird der Abgasstrom durch ein Yttrium-dotiertes Zirconiumdioxidröhrchen geleitet, welches innen und außen mit Platinelektroden versehen ist. Dabei steht dice äußere Elektrode in Kontakt mit der Umgebungsluft. Unterschiedliche O2-Partialdrücke an den Elektroden führen zu einer elektrischen Potentialdifferenz, die gemessen wird. Dice Vorteile dieser Messtechnik liegen in der niedrigen Nachweisgrenze von wenigen ppm und der großen Betriebstemperaturspanne (300 °C bis 1500 °C).[65] [66] [67]
Die Clark-Elektrode ist ein amperometrischer Sensor zur elektrochemischen Bestimmung von gelöstem, gasförmigem Sauerstoff.[68] Platin- und Ag/AgCl-Referenzelektrode befinden sich in einem Elektrolytsystem, welches durch eine gaspermeable Teflonmembran von der Probelösung getrennt ist. Gelöster Sauerstoff kann durch die Membran in dice Elektrolytlösung diffundieren und wird in einem Potentialbereich von −600 mV bis −800 mV kathodisch reduziert. Der gemessene Strom ist dabei proportional zur Sauerstoffkonzentration in der Probelösung.[67]
Bei den optischen Methoden bedient man sich der Tatsache, dass Sauerstoff die Fluoreszenz von angeregten Molekülen zu löschen vermag.[69] Auf Basis von fluoreszenten Übergangsmetallkomplexen wurden sog. Optroden entwickelt, die den Sauerstoffgehalt über die Fluoreszenzlöschung von Sondenmolekülen bestimmen. Als Sondenmoleküle kommen häufig Metall-Liganden-Komplexe zum Einsatz. Als Metallionen haben sich Ru(II), Ir(II), Pt(2) und Pd(2) bewährt, als Liganden verschiedene Bipyridine, Phenanthroline und (fluorierte) Porphyrine.[70] Dice Sonden werden in Polymermatrices eingebettet. Die Anregung erfolgt zumeist mit LEDs oder Laserdioden. Man unterscheidet zwischen punktuellen Messungen z. B. mittels optischer Lichtleiterfasern[71] und bildgebenden Messverfahren mittels planarer Sensorfilme.[72] Mit Optroden konnten Nachweisgrenzen von 5 ppbv (O2, ≈ five,1 · 10−half dozen hPa) erzielt werden, was einer Konzentration in Wasser von 7 pM entspricht.[73]
Verbindungen
Sauerstoff bildet Verbindungen mit fast allen Elementen – außer mit den Edelgasen Helium, Neon und Argon. Da Sauerstoff sehr elektronegativ ist, kommt es in fast allen seinen Verbindungen in den Oxidationsstufen −Ii vor, nur in Peroxiden −I. Diese Ionen werden auch als Closed-vanquish-Ionen bezeichnet. Peroxide sind meist instabil und gehen leicht in Oxide über.
Positive Oxidationszahlen besitzt Sauerstoff nur in Verbindungen mit dem noch elektronegativeren Chemical element Fluor, mit dem es Verbindungen mit der Oxidationsstufe +I (Disauerstoffdifluorid OtwoF2) und +2 (Sauerstoffdifluorid OF2) bildet. Da bei ihnen die negative Polarisierung beim Fluor vorliegt, werden diese nicht als Oxide, sondern als Fluoride, genauer gesagt Sauerstofffluoride, bezeichnet.
Neben den Oxidverbindungen tritt Sauerstoff noch in ionischen Verbindungen und Radikalen als Peroxid- (O2 2−), Hyperoxid- (O2 − (Oxidationsstufe −1/2)) und Ozonidanion (Othree − (Oxidationsstufe −i/three)) sowie als Dioxygenylkation (O2 +) auf.
Sauerstoff bildet abhängig vom Bindungspartner sowohl ionisch als auch kovalent aufgebaute Verbindungen.
Anorganische Sauerstoffverbindungen
Zu den anorganischen Sauerstoffverbindungen zählen die Verbindungen von Sauerstoff mit Metallen, Halbmetallen, Nichtmetallen wie Wasserstoff, Kohlenstoff, Stickstoff, Schwefel und den Halogenen. Sie gehören zu den wichtigsten Verbindungen überhaupt.
Oxide
Dice meisten Sauerstoffverbindungen sind Oxide. In ihnen tritt der Sauerstoff, ionisch oder kovalent gebunden, in der Oxidationsstufe −II auf. Viele natürlich vorkommende Salze, die oft wichtige Quellen zur Herstellung von Metallen sind, sind Oxide.

Mit den Metallen bildet Sauerstoff in niedrigen Oxidationsstufen ionisch aufgebaute und in der Regel basische Oxide.
- Bei der Verbrennung von Calcium in Anwesenheit von Sauerstoff entsteht Calciumoxid.
- Bei der Reaktion von Calciumoxid mit Wasser entsteht Calciumhydroxid.
Mit steigender Oxidationsstufe haben die Oxide zunehmend amphoteren (Zink(2)-oxid, Aluminium(III)-oxid) und schließlich sauren Charakter (Chrom(VI)-oxid).
- Chrom(VI)-oxid reagiert mit Wasser zu Chromsäure
Mit Nichtmetallen bildet Sauerstoff ausschließlich kovalente Oxide. Die Oxide von Nichtmetallen in niedrigen Oxidationsstufen reagieren meist neutral (Distickstoffmonoxid), mit steigender Oxidationsstufe zunehmend sauer.

Unter den Sauerstoffverbindungen der Nichtmetalle spielen die mit Wasserstoff eine gesonderte Rolle. Sauerstoff bildet mit Wasserstoff zwei Verbindungen. An erster Stelle ist das Wasser zu nennen, ohne das es kein Leben auf der Erde gäbe. Die zweite Verbindung ist das Wasserstoffperoxid (HtwoOii), eine thermodynamisch instabile Verbindung, dice als Oxidations- und Bleichmittel Verwendung findet.
Obwohl die meisten sauerstoffhaltigen Kohlenstoffverbindungen in den Bereich der organischen Chemie eingeordnet werden, gibt es einige wichtige Ausnahmen. Die einfachen Oxide des Kohlenstoffs Kohlenstoffmonoxid (CO) und Kohlenstoffdioxid (CO2), sowie dice Kohlensäure und deren Salze, die Carbonate, werden als anorganische Verbindungen angesehen.
Sind in einer salzartigen Verbindung geringere Mengen Oxidionen bekannt als nach der Stöchiometrie und Wertigkeit des Sauerstoffs zu erwarten, spricht man von Suboxiden. In diesen kommen Chemical element-Element-Bindungen vor, dice formale Oxidationsstufe des Elements liegt bei unter +i. Elemente, die Suboxide bilden, sind dice Alkalimetalle Rubidium und Caesium, aber auch Bor oder Kohlenstoff.
Sauerstoffverbindungen mit Sauerstoff-Sauerstoff-Bindungen
Vor allem mit Alkalimetallen bildet Sauerstoff Verbindungen mit Sauerstoff-Sauerstoff-Bindungen. Hierzu zählen die Peroxide, dice Hyperoxide und dice Ozonide. Peroxide wie Wasserstoffperoxid besitzen das Oii two−-Ion und eine formale Oxidationsstufe des Sauerstoffs von −1. Durch die leichte Spaltung der Sauerstoff-Sauerstoff-Bindung bilden sie leicht Radikale, die auf organische Substanzen bleichend wirken und dementsprechend als Bleichmittel eingesetzt werden. Es sind auch organische Peroxide bekannt.
In Hyperoxiden kommt das radikalische Dioxid(1−)-Anion O2 − vor, dice formale Oxidationsstufe ist −½ für jedes Sauerstoffatom. Hyperoxid-Ionen bilden sich im Stoffwechsel und zählen dabei zu den Reaktiven Sauerstoffspezies, salzartige Hyperoxide sind lediglich von den Alkalimetallen außer Lithium bekannt. Ozonide leiten sich vom Ozon ab und haben dementsprechend das O3 −-Anion. Salzartige Ozonide sind wie Hyperoxide von allen Alkalimetallen außer Lithium bekannt, dazu gibt es auch organische Ozonide, die durch Addition von Ozon an Alkene entstehen.
Hydroxide
Eine weitere große Gruppe der Sauerstoffverbindungen stellen die Hydroxide unter Beteiligung von Wasserstoff dar. Bei diesen handelt es sich um überwiegend ionische Verbindungen, denen das Hydroxidion gemein ist. Bis auf die Hydroxide der Alkalimetalle wie Natriumhydroxid (NaOH) oder Kaliumhydroxid (KOH) sind sie im Allgemeinen wenig löslich in Wasser.
Sauerstoffsäuren
Bei der Reaktion von Nichtmetalloxiden sowie Metalloxiden von Metallen in hohen Oxidationsstufen mit Wasser bilden sich dice sogenannten Sauerstoffsäuren, die für dice Namensgebung des Sauerstoffs verantwortlich sind.
- Beim Lösen von Schwefeltrioxid in Wasser bildet sich Schwefelsäure.
Die stärksten anorganischen Sauerstoffsäuren leiten sich von den Nichtmetallen Stickstoff (Salpetersäure) und Schwefel (Schwefelsäure) sowie den Halogenen ab (Halogensauerstoffsäuren). Dabei gilt die Regel, dass dice Säurestärke (pKs-Wert) mit zunehmender Anzahl von Sauerstoffatomen zunimmt:
| Name der Säure | Formel | Name der Salze | Säurekonstante (pKs)[74] |
|---|---|---|---|
| Kohlensäure | H2COiii | Carbonate | 6,35 |
| Orthokieselsäure | H4SiO4 | Silicate | 9,51 |
| Cyansäure | HOCN | Cyanate | 3,7 |
| Isocyansäure | HNCO | Cyanate | 3,92 |
| Hyposalpetrige Säure | H2NtwoOii | Hyponitrite | vii,21 |
| Salpetrige Säure | HNO2 | Nitrite | 3,29 |
| Salpetersäure | HNO3 | Nitrate | −1,37 |
| Phosphinsäure | HthreePO2 | Phosphinate | 2,0 |
| Phosphonsäure | H3PO3 | Phosphonate | 2,0 |
| Phosphorsäure | H3POiv | Phosphate | 2,16 |
| Thioschwefelsäure | HtwoS2Oiii | Thiosulfate | 0,six |
| Schweflige Säure | HiiAnd then3 | Sulfite | one,81 |
| Schwefelsäure | H2SO4 | Sulfate | −3 |
| Hypochlorige Säure | HClO | Hypochlorite | 7,54 |
| Chlorige Säure | HClOii | Chlorite | 1,97 |
| Chlorsäure | HClO3 | Chlorate | −2,7 |
| Perchlorsäure | HClO4 | Perchlorate | −10 |
Organische Sauerstoffverbindungen
Sauerstoff ist – neben Kohlenstoff, Wasserstoff und Stickstoff – eines der wichtigsten Elemente der organischen Chemie. Er bildet eine Vielzahl wichtiger funktioneller Gruppen, die sowohl Kohlenstoff-Sauerstoff-Einfachbindungen, als auch – in der Carbonylgruppe – Kohlenstoff-Sauerstoff-Doppelbindungen enthalten.
Zu den einfachsten organischen Verbindungen, die Sauerstoff enthalten, gehört Methanal (H2CO), das sich formal von Kohlenstoffdioxid (CO2) nur darin unterscheidet, dass statt des zweiten Sauerstoffatoms zwei Wasserstoffatome am Kohlenstoff gebunden sind. Wichtig für die Einteilung in die organische Chemie ist jedoch, dass sich Methanal von dem organischen Alkohol Methanol (CH3OH) ableitet, welcher wiederum ein Derivat des einfachsten Alkans Methan (CH4) ist.
Dice wichtigsten Verbindungklassen:
- Alkohole: Von der Kohlenstoff-Sauerstoff-Einfachbindung leiten sich einige wichtige Verbindungsklassen ab. Die erste sind die Alkohole, bei denen am Sauerstoffatom ein Kohlenstoff- und ein Wasserstoffatom (Hydroxygruppe) gebunden sind. Dice bekanntesten und gleichzeitig einfachsten Vertreter dieser Gruppe sind Methanol CHiiiOH und Ethanol C2H5OH.
- Phenole: Diese Moleküle enthalten mindestens eine Hydroxygruppe, die mit einem aromatischen Ring verbunden ist.
![]()
- Ether: Sind am Sauerstoffatom zwei Kohlenstoffatome gebunden, wird die Gruppe Ethergruppe genannt und die Stoffklasse entsprechend Ether. Ein bekannter Vertreter der Ether ist das wichtige Lösungsmittel Diethylether (C2Hfive)2O.
- Aldehyde: Die Carbonylgruppe ist eine sehr vielseitige funktionelle Gruppe, die in vielen Stoffklassen enthalten ist. Diese unterscheiden sich darin, welche zusätzlichen Gruppen am Kohlenstoffatom gebunden sind. Die Aldehydgruppe R–CHO, bei der am Kohlenstoffatom der Carbonylgruppe ein Wasserstoffatom gebunden ist, kommt in Aldehyden wie Acetaldehyd vor.
- Ketone: Sie enthalten dice Ketogruppe, R–CO–R, bei der am Kohlenstoffatom der Carbonylgruppe zwei Kohlenwasserstoffreste gebunden sind. Ein Beispiel ist Aceton.

- Carbonsäuren: Die Carboxygruppe R–COOH der Carbonsäuren besitzt an einem Kohlenstoffatom sowohl eine Carbonylgruppe, als auch eine Hydroxygruppe. Die wichtigsten Carbonsäuren sind die Ameisen- und die Essigsäure.
- Ester: Ähnlich der Carboxygruppe ist die Estergruppe R–CO–O–R′ aufgebaut. Bei ihr ist das Proton der Carbonsäure durch einen weiteren Kohlenwasserstoffrest ausgetauscht. Die aus Carbonsäuren und Alkoholen gebildeten Ester werden entsprechend benannt. Ein Beispiel ist Essigsäureethylester aus Essigsäure und Ethanol (Ethylalkohol).
- Carbonsäureamide: In ihnen ist die Hydroxygruppe der Carboxygruppe durch eine Aminogruppe ausgetauscht.
Eine weitere wichtige Gruppe organischer Sauerstoffverbindungen sind die Kohlenhydrate oder Saccharide. Chemisch sind dies Polyhydroxycarbonylverbindungen (Hydroxyaldehyde oder Hydroxyketone). Sie kombinieren as well Eigenschaften der Alkohole mit denen der Aldehyde und Ketone.
Daneben existieren noch eine Reihe weiterer Verbindungen mit funktionellen Gruppen, bei denen der Sauerstoff an ein weiteres Heteroatom, wie etwa Stickstoff, Schwefel oder Phosphor, beispielsweise bei organischen Phosphaten (etwa ATP oder innerhalb der Deoxyribonucleic acid-Moleküle) gebunden ist.
Siehe auch
- Erdatmosphäre
- Flüssigsauerstoff
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-one, S. 497–540.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. i. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 775–839.
- Ralf Steudel: Chemie der Nichtmetalle. de Gruyter, Berlin 1998, ISBN 3-xi-012322-iii.
- Nick Lane: Oxygen – the molecule that made the earth. Oxford Univ. Printing, Oxford 2003, ISBN 0-19-860783-0.
Weblinks
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. South. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-iii.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Sauerstoff) entnommen.
- ↑ Angegeben ist der von der IUPAC empfohlene Standardwert, da dice Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für die mittlere Atommasse der in Klammern angegebene Bereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Written report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-fourteen.
- ↑ IUPAC, Standard Atomic Weights Revised 2013.
- ↑ a b c d due east f Eintrag zu oxygen in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.ane). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e f Eintrag zu oxygen bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ a b c Eintrag zu Sauerstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Baronial 2016. (JavaScript erforderlich)
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemical science and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. East-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. Grand. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Periodical of Chemical & Engineering Data. 56, 2011, South. 328–337, doi:10.1021/je1011086.
- ↑ Eintrag zu Oxygen im Nomenclature and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Baronial 2016. Hersteller bzw. Inverkehrbringer können dice harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Sauerstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am xx. Dezember 2012.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Sauerstoff im Lexikon der Geowissenschaften, abgerufen am xx. Dezember 2012.
- ↑ Due east. Pilgrim: Entdeckung der Elemente. Mundus Verlag, Stuttgart 1950.
- ↑ Rudolf Frey, Otto Mayrhofer, mit Unterstützung von Thomas E. Keys und John S. Lundy: Wichtige Daten aus der Geschichte der Anaesthesie. In: R. Frey, Werner Hügin, O. Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie und Wiederbelebung. Springer, Heidelberg/Basel/Wien 1955; two., neubearbeitete und erweiterte Auflage. Unter Mitarbeit von H. Benzer. Springer-Verlag, Berlin/Heidelberg/New York 1971. ISBN three-540-05196-one, S. 13–16, hier: S. fourteen.
- ↑ Georg Fischer: Chirurgie vor 100 Jahren. Historische Studie. [Gewidmet der Deutschen Gesellschaft für Chirurgie]. Verlag von F. C. W. Vogel, Leipzig 1876; Neudruck mit dem Untertitel Historische Studie über das 18. Jahrhundert aus dem Jahre 1876 und mit einem Vorwort von Rolf Winau: Springer-Verlag, Berlin/ Heidelberg/ New York 1978, ISBN 3-540-08751-6, S. 377.
- ↑ Joseph Priestley: An Account of Further Discoveries in Air. By the Rev. Joseph Priestley, LL.D. F. R. Southward. in Letters to Sir John Pringle, Bart. P. R. Southward. and the Rev. Dr. Price, F. R. S. In: Phil. Trans. 65, 1. Januar 1775, Southward. 384–394; doi:10.1098/rstl.1775.0039 (Volltext).
- ↑ Claude Allègre, Gérard Manhès, Éric Lewin: Chemical limerick of the Earth and the volatility control on planetary genetics. In: World and Planetary Scientific discipline Letters. 185 (ane–ii), 2001, S. 49–69; doi:ten.1016/S0012-821X(00)00359-9.
- ↑ a b dtv-Atlas Chemie. Band 1, dtv-Verlag, 2000.
- ↑ a b c d due east f A. F. Holleman, Eastward. Wiberg, Due north. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, South. 497–540.
- ↑ A. Chiliad. Davies (Hrsg.): Treatise on Geochemistry. Volume 1: Meteorites, Comets, and Planets. Elsevier, 2003, ISBN 0-08-044720-1.
- ↑ Glenn J. MacPherson: Oxygen in the solar system. Mineralogical Club of America, Chantilly 2008, ISBN 978-0-939950-lxxx-five.
- ↑ R. Kippenhahn, A. Weigert: Stellar Construction and Evolution. 1. Auflage. Springer, Berlin 1991, ISBN 3-540-58013-1.
- ↑ a b Funktionsprinzip einer Sauerstoff-Produktionsanlage.
- ↑ a b c N. Due north. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN three-527-26169-9, S. 775–839.
- ↑ Prinzip der Gastrennung durch Adsorption (air liquide).
- ↑ M. J. Kirschner: Oxygen In: Ullmann'due south Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2012, doi:10.1002/14356007.a18_329
- ↑ National Concrete Laboratory: Kaye and Laby Tables of Physical and Chemic Constants. 16. Auflage. 1995; D. Ambrose, Grand. B. Ewing, 1000. Fifty. McGlashan: Critical constants and 2d virial coefficients of gases. (Memento vom 24. März 2017 im Net Archive)
- ↑ J. A. Dean: Lange'south Handbook of Chemistry. xv. Auflage. McGraw-Loma, 1999; Section 6; Table 6.v Disquisitional Properties
- ↑ Physikalische Eigenschaften
- ↑ Sauerstoff Spektralröhre.
- ↑ Keisuke Hasegawa: Direct measurements of absolute concentration and lifetime of singlet oxygen in the gas stage by electron paramagnetic resonance. In: Chemic Physics Letters. 457 (4–6), 2008, Due south. 312–314; doi:10.1016/j.cplett.2008.04.031.
- ↑ Due north. V. Shinkarenko, V. B. Aleskovskiji: Singlet Oxygen: Methods of Preparation and Detection. In: Russian Chemic Reviews. 50, 1981, Southward. 320–231; doi:10.1070/RC1981v050n03ABEH002587.
- ↑ Michael Gemki, Ömer Taspinar, Andreas Adler, Axel Thousand. Griesbeck, Dirk Gründemann: Scalable Synthesis of N,N′-Di(ii,iii-dihydroxy-propyl)-one,4-naphthalenedipropanamide and Its one,4-Endoperoxide every bit a Singlet Oxygen-Releasing Molecule. In: Organic Process Inquiry & Development. Band25, Nr.12, 17. Dezember 2021, ISSN1083-6160, S.2747–2753, doi:10.1021/acs.oprd.1c00364 (acs.org [abgerufen am 3. Januar 2022]).
- ↑ Peter Lechtken: Singulett-Sauerstoff. In: Chemie in unserer Zeit. Bandviii, Nr.one, 1974, S.eleven–16, doi:10.1002/ciuz.19740080103.
- ↑ Video, das das rote Leuchten von Singulett-Sauerstoff zeigt
- ↑ Maria C DeRosa, Robert J Crutchley: Photosensitized singlet oxygen and its applications. In: Coordination Chemistry Reviews. Ring233-234, 1. November 2002, ISSN0010-8545, Southward.351–371, doi:10.1016/S0010-8545(02)00034-6 (sciencedirect.com [abgerufen am 3. Januar 2022]).
- ↑ Waldemar Adam, Dmitri V. Kazakov, Valeri P. Kazakov: Singlet-Oxygen Chemiluminescence in Peroxide Reactions. In: Chemical Reviews. Band105, Nr.9, 1. September 2005, ISSN0009-2665, S.3371–3387, doi:ten.1021/cr0300035 (acs.org [abgerufen am 3. Januar 2022]).
- ↑ Peter R. Ogilby: Singlet oxygen: at that place is indeed something new under the lord's day. In: Chemical Society Reviews. Band39, Nr.8, 22. Juli 2010, ISSN1460-4744, S.3181–3209, doi:10.1039/B926014P (rsc.org [abgerufen am iii. Januar 2022]).
- ↑ Ashwini A. Ghogare, Alexander Greer: Using Singlet Oxygen to Synthesize Natural Products and Drugs. In: Chemical Reviews. Band116, Nr.17, xiv. September 2016, ISSN0009-2665, S.9994–10034, doi:10.1021/acs.chemrev.5b00726 (acs.org [abgerufen am 3. Januar 2022]).
- ↑ Universität Bayreuth: Kohlenstoffdioxid und Kohlensäure
- ↑ Katalytische Oxidation von Schwefeldioxid
- ↑ Juergen Carstens: Berechnung der NOx-Rohemission eines Verbrennungsmotor im Schichtladebetrieb. In: The IP.com Journal. 2003.
- ↑ Grand. Brauer; Handbuch der präparativen anorganischen Chemie, F. Enke Verlag 1978, ISBN 978-3-432-26081-5.
- ↑ F. Cacace, Thousand. De Petris, A. Troiani: Experimental Detection of Tetraoxygen In: Angewandte Chemie (International ed. in English). Band 40, Nummer 21, November 2001, S. 4062–4065. PMID 12404493; doi:ten.1002/1521-3773(20011105)forty:21<4062::AID-ANIE4062>iii.0.CO;2-10
- ↑ Philip Ball: New grade of oxygen found. In: Nature News. sixteen. November 2001, abgerufen am 10. September 2013 (englisch, doi:ten.1038/news011122-3).
- ↑ a b G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, South. Naimi: The NUBASE2016 evaluation of nuclear backdrop. In: Chinese Physics C. 41, 2017, South. 030001, doi:x.1088/1674-1137/41/3/030001 (Volltext).
- ↑ NMR-Eigenschaften von Sauerstoff bei www.webelements.com
- ↑ Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz – AMG), § 50. Fassung der Bekanntmachung vom 12. Dezember 2005 (BGBl. 2005 I Due south. 3394), zuletzt geändert durch Artikel thirty des Gesetzes vom 26. März 2007.
- ↑ A. New: Oxygen: kill or cure? Prehospital hyperoxia in the COPD patient. In: Emerg Med J. 23, 2006, S. 144–146. PMID 16439751.
- ↑ F. J. Andrews, J. P. Nolan: Disquisitional care in the emergency department: monitoring the critically sick patient. In: Emerg Med J. 23, 2006, Southward. 561–564. PMID 16794104.
- ↑ Deutsche Gesellschaft für Pneumologie: Empfehlungen zur Sauerstoff-Langzeit-Therapie bei schwerer chronischer Hypoxämie. In: Pneumologie. 74, 1993, S. 2–4.
- ↑ S. Iscoe, J. A. Fisher: Hyperoxia-induced hypocapnia: an underappreciated take a chance. In: Chest. 128 (1), Jul 2005, South. 430–433. PMID 16002967; doi:10.1378/chest.128.1.430.
- ↑ Paul K. Macey, Mary A. Woo, Ronald M. Harper: Hyperoxic Brain Effects Are Normalized by Addition of CO2. In: Public Library of Science Medicine. four (v), 2007, S. e173; doi:10.1371/journal.pmed.0040173.
- ↑ WHO – Lifting The Burden: Aids for management of common headache disorders in primary care. (PDF-Datei; 279 kB).
- ↑ Leitlinie Clusterkopfschmerz und trigeminoautonome Kopfschmerzen. Herausgegeben von der Kommission Leitlinien der Deutschen Gesellschaft für Neurologie, der Deutschen Migräne- und Kopfschmerzgesellschaft, der Österreichischen Gesellschaft für Neurologie, der Schweizerischen Neurologischen Gesellschaft und dem Berufsverband deutscher Neurologen. Stand: 14. Mai 2015, gültig bis 13. Mai 2020.
- ↑ Dimitriadou Agapi, Komi Evangelia, Lykou Maria: Urbaner Metabolismus – Wasseraufbereitung in Kapitel 5, Abschnitt v.7
- ↑ Zusatzstoff-Zulassungsverordnung: Anlage three (zu § 5 Abs. 1 und § 7) Allgemein zugelassene Zusatzstoffe .
- ↑ Alkoholfreie Getränke. Die Untersuchungsämter für Lebensmittelüberwachung und Tiergesundheit, Baden-Württemberg. 2008.
- ↑ Graz: Forscher verlängern Lebensdauer von Batterien orf.at, xx. März 2017, abgerufen am 21. März 2017.
- ↑ Nika Mahne, Bettina Schafzahl u. a.: Singlet oxygen generation as a major crusade for parasitic reactions during cycling of aprotic lithium–oxygen batteries. In: Nature Free energy. 2, 2017, S. 17036, doi:10.1038/nenergy.2017.36.
- ↑ Spektrum der Wissenschaft Verlagsgesellschaft mbH: Photosynthese
- ↑ Ulrich Helmich: Atmung, Dissimilation
- ↑ Vgl. etwa W. B. Davis, Due south. I. Rennard, P. B. Bittermann, R. Thousand. Crystal: Pulmonary oxygen toxicity: Early on reversible changes in human alveolar structures induces by hyperoxia. In: New England Journal ofr Medicine. Band 309, 1983, S. 878 ff.
- ↑ Fifty. G. Anderson, C. Haraldsson, R. Lindgren: Gran linearization of potentiometric Winkler titration. In: Marine Chemistry. 37 (iii–four), 1992, S. 179–190; doi:ten.1016/0304-4203(92)90077-N.
- ↑ J. Riegel, H. Neumann, H.-M. Wiedenmann: Exhaust gas sensors for automotive emission control. In: Solid State Ionics. 152/153, 2002, Southward. 783–800; doi:x.1016/S0167-2738(02)00329-half-dozen.
- ↑ G. Eranna, B. C. Joshi, D. P. Runthala, R. P. Gupta: Oxide Materials for Development of Integrated Gas Sensors – A Comprehensive Review. In: Crit. Rev. Solid Country Mat. Sci. 29, 2004, Due south. 111–188; doi:ten.1080/10408430490888977.
- ↑ a b Eastward. Gnaiger, H. Forstner: Polarographic Oxygen Sensors. Springer-Verlag, Berlin/ Heidelberg/ New York 1983.
- ↑ J. R. Stetter, J. Li: Amperometric Gas Sensors – A Review. In: Chemical Reviews. 108 (ii), 2008, S. 352–366; doi:ten.1021/cr0681039.
- ↑ C. McDonagh, C. S. Shush, B. D. MacCraith: Optical Chemical Sensors. In: Chemical Reviews. 108 (2), 2008, S. 400–422; doi:10.1021/cr068102g.
- ↑ Y. Amao: Probes and Polymers for Optical Sensing of Oxygen. In: Microchimica Acta. 143, 2003, Southward. ane–12; doi:10.1007/s00604-003-0037-x.
- ↑ S. Arain, Southward. Weiss, E. Heinzle, Thousand. T. John, C. Krause, I. Klimant: Gas Sensing in Microplates with Optodes: Influence of Oxygen Exchange Betwixt Sample, Air and Plate Material. In: Biotechnology and Bioengineering. Vol. 90, No. 3, 2005, S. 271–280.
- ↑ One thousand. I. J. Stich, L. H. Fischer, O. South. Wolfbeis: Multiple fluorescent chemic sensing and imaging. In: Chemical Society Reviews. 39, 2010, S. 3102–3114.
- ↑ P. Lehner, C. Staudinger, S. M. Borisov, I. Klimant: Ultra-sensitive optical oxygen sensors for label of nearly anoxic systems. In: Nature Communications. 5, 2014, Southward. 4460; doi:x.1038/ncomms5460.
- ↑ A. F. Holleman, Eastward. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-one.
Source: https://de.wikipedia.org/wiki/Sauerstoff


















0 Response to "Wie Viele Valenzelektronen Hat Sauerstoff"
Post a Comment